La tavola periodica degli elementi, chiamata anche tavola di Mendeleev, dal suo creatore, è uno strumento indispensabile nello studio della chimica. Essa classifica gli atomi in base al loro numero atomico crescente.
La creazione della tavola periodica
La tavola periodica degli elementi è stata ideata e realizzata per la prima volta nel 1869 dal chimico russo Dmitri Mendeleev.
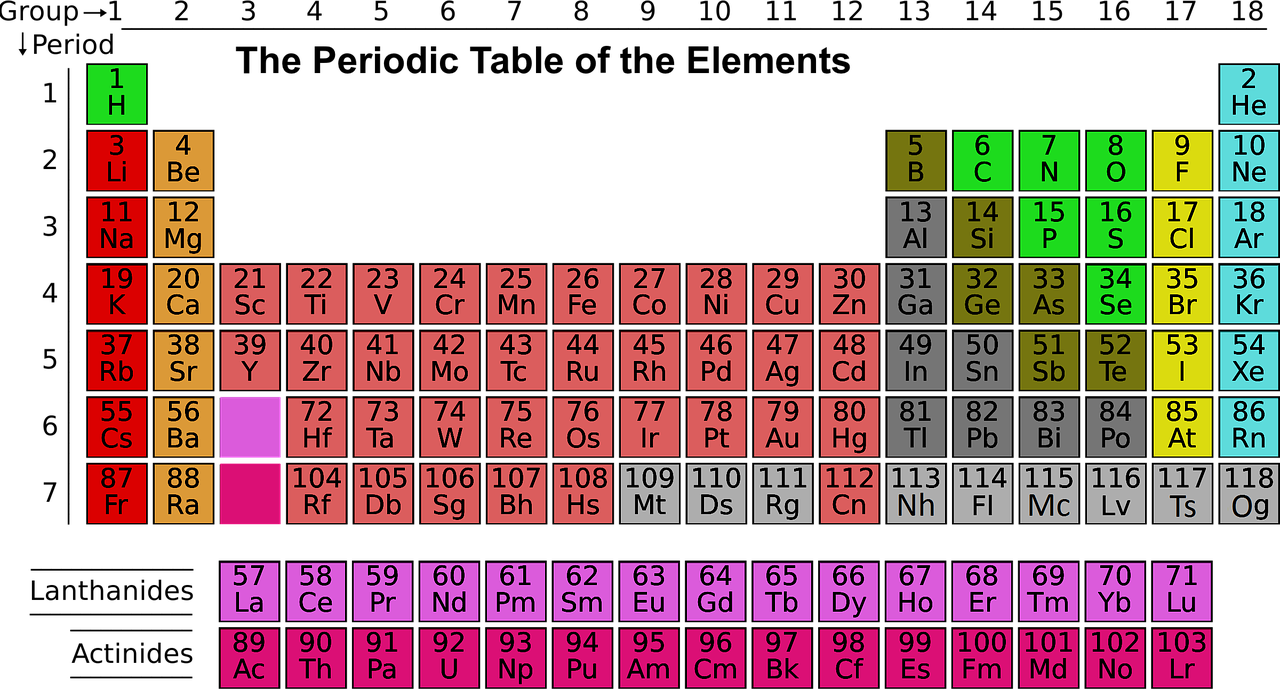
Tavola periodica
Mendeleev organizzò gli elementi in base a proprietà chimiche simili e li dispose in base al loro numero atomico crescente.
Organizzando gli elementi in questo modo apparvero evidenti degli spazi vuoti da riempire con elementi non ancora scoperti.
Oggi, infatti, gli elementi presenti nella tavola periodica sono 118, ma nella versione ideata da Mendeleev erano solamente 63. Nel corso degli anni la tavola si è evoluta e diversi chimici vi hanno messo mano aggiungendo nuovi elementi.
Ancora oggi la tavola presente degli spazi vuoti ed è ancora in evoluzione. Attualmente gli scienziati sono al lavoro per aggiungere gli elementi numero 119 e 120.
La struttura della tavola periodica
A prima vista potrebbe sembrare complicato leggere la tavola periodica, in realtà conoscendone meglio la struttura scopriremo che è abbastanza semplice.
Come detto, Mendeleev ha organizzato gli elementi in base a proprietà simili e li ha disposti in base al loro numero atomico crescente.
Simboli e numeri
Prendiamo gli elementi presenti sulla tavola singolarmente. Ogni elemento è rappresentato con un simbolo. Attorno al simbolo sono presenti diversi numeri. Il simbolo è formato da una o due lettere che indicano il nome dell’elemento. Ad esempio, l’idrogeno è rappresentato dalla lettera H.

Elementi della tavola periodica
I numeri, invece, indicano le varie caratteristiche degli elementi e sono così disposti:
- Numero atomico: in alto a destra.
- Massa atomica: in alto a sinistra.
Quasi sempre vengono rappresentati anche l’elettronegatività e l’energia di prima ionizzazione. Alcune tavole più approfondite riportano anche gli stati di ossidazione e la configurazione elettronica.
Gruppi, periodi e blocchi
Mendeleev ha diviso gli elementi in base a proprietà simili in questo modo:
- Blocchi (4): in base al nome dell’ultimo orbitale. Nelle tavole sono rappresentati con colori diversi.
- Gruppi (18): le colonne.
- Periodi (7): le righe.
I blocchi sono:
- Il blocco S: comprende il primo e il secondo gruppo. L’ultimo orbitale è S.
- Blocco P: comprende 6 gruppi. L’ultimo orbitale è P.
- Il blocco D: comprende 10 gruppi. L’ultimo orbitale è D.
- Blocco F: comprende i lantanidi e gli attinidi. L’ultimo orbitale è F.
Le categorie degli elementi della tavola periodica
Gli elementi raggruppati nella tavola periodica si dividono in: metalli, semi-metalli e non metalli. A loro volta, questi si dividono in base alle loro proprietà fisiche e chimiche.
I metalli sono:
- Metalli alcalini: litio, sodio, potassio, rubidio, cesio e francio (primo gruppo).
- Metalli alcalino terrosi: berillio, magnesio, calcio, stronzio, bario e radio (secondo gruppo).
- Metalli di transizione: sono tutti gli elementi che vanno dal terzo al dodicesimo gruppo.
- Metalli post-transizione: alluminio, gallio, indio, stagno, tallio, piombo, bismuto, nihonio, flerovio, moscovio.
- Lantanidi: lantanio e lutezio.
- Attinidi: attinio e laurenzio.
I lantanidi e gli attinidi vengono anche chiamati terre rare.
Ci sono poi i:
- Semi-metalli: boro, silicio, germanio, arsenico, antimonio, tellurio e polonio.
- Non metalli: idrogeno, carbonio, azoto, fosforo, ossigeno, zolfo, selenio, fluoro, cloro, bromo, iodio, astato e tennesso. Quelli del 17esimo gruppo sono anche chiamati alogeni.
- Gas nobili: elio, neon, argon, kripton, xenon, radon e oganesson (18esimo gruppo).
Proprietà periodiche della tavola periodica
Infine, le proprietà periodiche degli elementi della tavola periodica sono quattro:
- Elettronegatività: è la tendenza di un elemento ad attrarre gli elettroni. È rappresentato con En.
- Energia di ionizzazione: è l’energia necessaria per strappare un elettrone da un elemento. È rappresentato con E1i.
- Affinità elettronica: è l’energia rilasciata da un atomo nel momento in cui si aggiunge un elettrone. È rappresentato con Ae.
- Raggio atomico: è il valore che indica le dimensioni di un elemento.